ظاهرة العبور: تأثيرها على التنوع الوراثي
تُعَدّ ظاهرة العبور (Crossing Over) واحدة من أبرز الظواهر الحيوية التي أسهمت في تشكيل التنوع الوراثي لدى الكائنات الحية على مدار التاريخ التطوري. يحدث العبور في أثناء الانقسام المنصف (Meiosis) حيث تتبادل الكروموسومات المتماثلة مقاطع وراثية بينها، مما يؤدي إلى إعادة خلطٍ للمعلومات الجينية وتوليد تراكيب وراثية جديدة. ومن هنا تنبع أهمية هذه الظاهرة في دعم التنوع الحيوي وتوسيع مدى الاحتمالات التطورية، إذ تُعتبر آلية حاسمة في عملية تطوّر وانتخاب الكائنات. يعكس العبور في جوهره تفاعلات بيولوجية معقّدة تحكمها بروتينات متخصّصة وآليات تنظيمية دقيقة، وهو ليس مجرد حدث عشوائي بل يخضع لتأثيرات داخلية (جينية وخلويّة) وخارجية (بيئية) متداخلة. في هذا المقال المطوّل، سيتناول النقاش الإطار التاريخي لاكتشاف ظاهرة العبور، والأسس الجزيئية والكيميائية التي تقوم عليها، وكيفية تأثيرها على التنوع الوراثي والتطوّر. كما سيتم التطرّق إلى التطبيقات العملية التي تستغل هذه الظاهرة في العلوم الوراثية، وخاصة في برامج التربية النباتية والحيوانية، مع التركيز على العوامل المؤثرة في معدلات العبور والجدوى التطبيقية لهذه المعرفة في مجالات الهندسة الوراثية والطب الحيوي.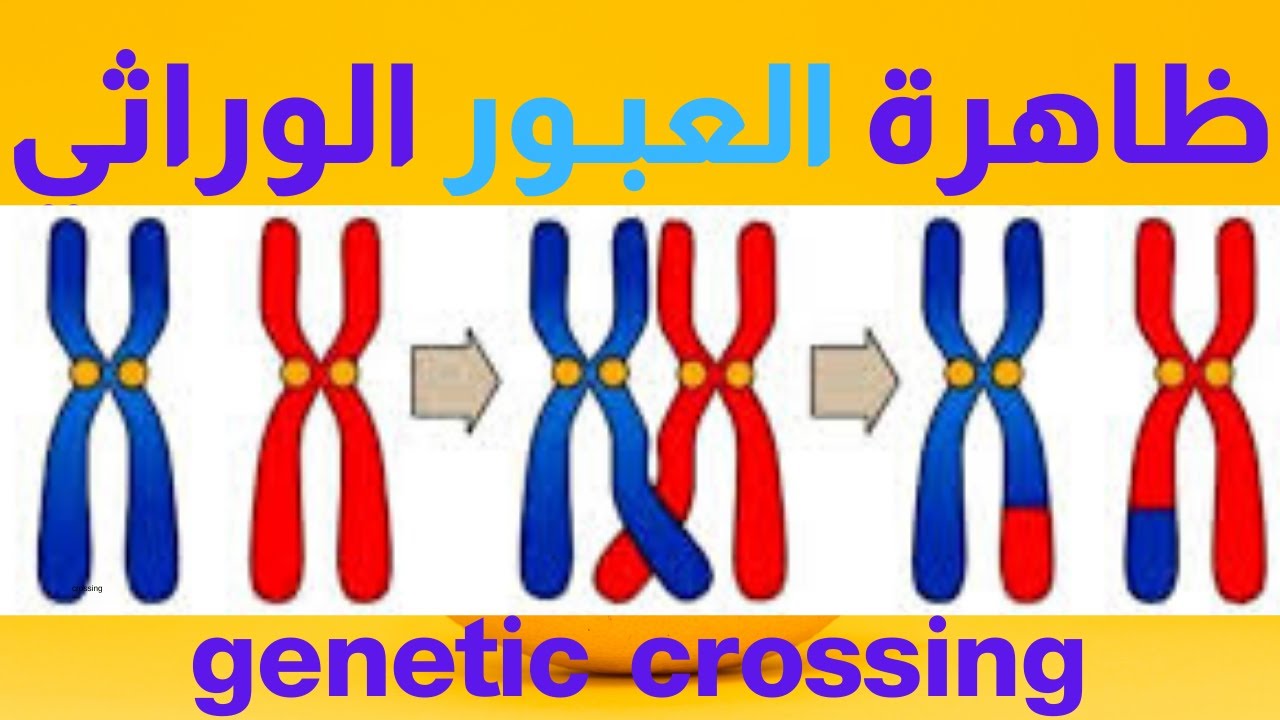
الإطار التاريخي لاكتشاف ظاهرة العبور
ارتبطت بدايات الوعي العلمي بظاهرة العبور باكتشافات القرن العشرين المبكرة في علم الوراثة. كان عالم الأحياء توماس هانت مورغان (Thomas Hunt Morgan) وفريقه من أوائل من ربطوا بين تبادل أجزاء الكروموسومات وبين ظاهرة إعادة التركيب الوراثي. من خلال تجاربه على ذبابة الفاكهة (Drosophila melanogaster)، لاحظ مورغان أن بعض الصفات الوراثية لا تتبع الأنماط المندلية الكلاسيكية بدقة، حيث ظهرت أنماط توريث جديدة لم تكن متوقعة. قادته هذه المشاهدات إلى اقتراح أن الكروموسومات المتماثلة يمكن أن تتبادل مقاطع وراثية معينة في أثناء تشكل الأمشاج، فتنشأ تراكيب جينية مختلفة عما كان سائداً في الأجيال السابقة.
تطوّرت هذه الفكرة إلى نظرية متكاملة تشرح آلية العبور بوصفها شكلًا من أشكال إعادة التركيب (Recombination). لاحقًا، استدل الباحثون من التجارب الجينية المكثفة على أن معدلات العبور بين الجينات المتجاورة تكون أقل مقارنةً بالجينات المتباعدة، الأمر الذي شكّل حجر الأساس لبناء خرائط الربط (Linkage Maps). هذه الخرائط تبيّن ترتيب الجينات على الكروموسومات وفقًا لدرجة قُربها الوراثي. أدى هذا الاكتشاف إلى نقلة نوعية في علم الوراثة، حيث صار بالإمكان تحديد المواقع النسبية للجينات على الكروموسومات، وتعقّب انتقالها في أثناء التكاثر، وبالتالي استثمارها في التطبيقات الزراعية والطبية لاحقًا.
أساسيات الانقسام المنصف ودور العبور فيه
مراجعة عامة للانقسام المنصف
الانقسام المنصف هو العملية الخلوية التي تُنتج الأمشاج (الجاميتات) في الكائنات الحقيقية النوى، مثل الحيوانات والنباتات والفطريات. يهدف هذا الانقسام إلى تقليل عدد الكروموسومات إلى النصف، بحيث تحتوي كل خلية جنسية على مجموعة أحادية (n) بدلًا من ثنائية (2n). يتكون الانقسام المنصف من مرحلتين رئيسيتين: الانقسام المنصف الأول (Meiosis I)، والانقسام المنصف الثاني (Meiosis II). في الانقسام الأول، تفترق الكروموسومات المتماثلة إلى خليتين، وفي الثاني، تنفصل الكروماتيدات الشقيقة لتكوين أربع خلايا أحادية الكروموسومات.
يحدث العبور تحديدًا في الطور التمهيدي الأول من الانقسام المنصف (Prophase I)، وبالأخص في المرحلة الفرعية المسماة بالباكيتين (Pachytene). خلال هذه المرحلة، تقترب الكروموسومات المتماثلة من بعضها البعض فيما يُعرف بعملية الاقتران (Synapsis)، حيث يتشكل هيكل بروتيني يدعى المركب المشبكي (Synaptonemal Complex) يثبت الكروموسومات المتماثلة متلاصقة بطولها. يتيح هذا التلاصق تبادل المقاطع الوراثية عن طريق قصّ وإعادة وصل أجزاء من الكروموسومات.
الميكانيكية الخلوية والجزيئية للعبور
يتضمن العبور سلسلة من الخطوات الجزيئية المعقدة. تبدأ العملية بإحداث كسور دقيقة في شريطي الدنا في كلا الكروموسومين المتماثلين، وهذه الفجوات يتم إصلاحها وفق آليات الإصلاح المعتمدة على الشريط المماثل (Homologous Recombination Repair). تتدخل مجموعة من الإنزيمات والبروتينات المتخصصة في هذا الإصلاح، مثل إنزيمات إندونيوكلياز (Endonucleases) التي تقطع الدنا، وبروتينات RecA في البكتيريا أو Rad51 في حقيقيات النوى التي تساهم في توجيه الشريط المنفصل نحو الشريط المكمل في الكروموسوم المماثل. ثم تتشكل بنية التقاطع المعروفة باسم “تقاطع هوليداي” (Holliday Junction)، والتي تُعد نقطة محورية في عملية تبديل الأشرطة.
بعد ذلك، يمكن أن يتحرك هذا التقاطع على طول الكروموسومات المترابطة في ما يشبه الانزلاق، وهي عملية يشار إليها بـ”هجرة الفروع” (Branch Migration). في النهاية، يحسم هذا التقاطع (Resolution) عن طريق قطع متقابل في منطقة التقاطع، مما يؤدي إلى تبادل القطع بين الكروموسومات المتماثلة. تختلف النتيجة تبعًا لجهة القطع؛ فقد ينشأ حدث العبور الكامل حيث يحدث تبديل واضح للقطع الطرفية، أو قد ينشأ ما يسمى بالتحويل الجيني (Gene Conversion) إذا جرى إصلاح الفجوات بشكلٍ مختلف.
الأهمية البيولوجية لظاهرة العبور في التنوع الوراثي
لا شك أن العبور يؤدي دورًا محوريًا في توسيع قاعدة التنوع الوراثي للكائنات الحية. فالتركيب الجيني للفرد الناتج عن اتحاد مشيجين مختلفين يحمل مزيجًا واسعًا من الأليلات. هذا التنوع يساعد في تعزيز القدرة على التكيف مع الظروف البيئية المتغيرة، ويوفر مادة خام لانتخاب الصفات المفيدة على المدى الطويل. علاوة على ذلك، يرتبط العبور باستمرار بإمكانية فصل الجينات المرتبطة (Linked Genes) على الكروموسوم نفسه؛ إذ إن الجينات المتباعدة مكانيًا على الكروموسوم ذاته تكون فرص فصلها عن طريق العبور أكبر. هذا الانفصال يُعزّز احتمالية ظهور تراكيب وراثية جديدة.
يلعب العبور أيضًا دورًا مهمًا في الحفاظ على الاستقرار الجيني. فرغم أن الهدف الأساسي من الانقسام المنصف هو تقليل عدد الكروموسومات وتكوين أمشاج صحيحة، إلّا أن آلية العبور تساعد على إصلاح بعض الأضرار التي قد تحدث للدنا أثناء مراحل الحياة الخلوية السابقة. بمعنى آخر، قد تكون عملية العبور شكلًا من أشكال الإصلاح الجيني الذي يمنع تراكم الطفرات الضارة. بهذا، يتضافر العبور مع آليات وراثية وتنظيمية أخرى لضمان سلامة الجينوم عبر الأجيال.
الأسس الجزيئية لتنظيم ظاهرة العبور
العوامل الوراثية المشرفة على معدل العبور
يمتلك كل نوع من الكائنات الحية معدلًا خاصًا بالعبور يتم تحديده بناءً على مجموعة من العوامل الجينية والبنيوية. على سبيل المثال، تُعتبر حجم الكروموسوم وترتيب الجينات وطبيعة تسلسل الدنا من المحددات المهمة لمعدل العبور. في بعض الكائنات، مثل ذبابة الفاكهة، دُرست الجينات المسؤولة عن تنظيم معدلات العبور وتبين أن هناك عوامل ترتبط بالمركب المشبكي وتتحكم في عدد التقاطعات (Crossovers) التي تحدث على امتداد الكروموسوم.
يحدث أحيانًا ما يعرف بالتداخل (Interference)، وهو ظاهرة تؤثر في توزيع أحداث العبور على طول الكروموسوم. فإذا حدث عبور في موضع معين، قد ينخفض أو يزيد احتمال حدوث عبور قريب في المنطقة المجاورة، بحسب نوع التداخل الإيجابي أو السلبي. تُعدّ بروتينات مثل MSH4 وMSH5 في حقيقيات النوى ذات دور مهم في تحديد عملية الإصلاح ومعالجة التقاطعات، ما يؤثر في تكوين نقاط العبور.
العوامل البيئية المؤثرة في معدل العبور
إلى جانب العوامل الوراثية المباشرة، قد تؤثر عوامل بيئية عديدة على معدل العبور. تشمل هذه العوامل: درجة الحرارة، والإجهاد المائي، والتعرض للإشعاعات أو المواد الكيميائية المؤثرة في الدنا. ثمة أبحاث عديدة تشير إلى أن بعض الكائنات مثل النباتات يمكن أن تزيد من معدل العبور تحت ظروف إجهادية معينة، ربما لتعزيز فرص ظهور تراكيب وراثية تساعد على التأقلم. في الوقت نفسه، تُظهر بعض الدراسات أن هناك حدودًا قصوى أو دنيا لمعدل العبور لا يمكن تجاوزها حتى في ظل التأثيرات البيئية القوية، ما يبرز طبيعة التوازن الدقيق الذي تحافظ عليه الخلايا بين الحاجة إلى التنوع والحفاظ على استقرار الجينوم.
دور ظاهرة العبور في بناء خرائط الربط الجينية
مفهوم خرائط الربط
تستند خرائط الربط (Linkage Maps) على مبدأ أن الجينات المتمركزة على الكروموسوم نفسه تكون مرتبطة ببعضها. لكن نسبة هذه الارتباطات ليست ثابتة بسبب ظاهرة العبور التي تفصل الجينات فيما بينها بمعدلات تختلف تبعًا لبُعد المسافة بينها. إذا كانت المسافة كبيرة، يرتفع احتمال حدوث العبور بينها، وبالتالي ترتفع نسبة إعادة التركيب (Recombination Rate)، في حين تقل هذه النسبة بين الجينات المتقاربة على نفس الكروموسوم.
من خلال قياس نسبة إعادة التركيب بين أزواج مختلفة من الجينات، استطاع العلماء وضع تصورات حول ترتيب الجينات على الكروموسوم وفواصل المسافات النسبية بينها. يُستخدم مقياس “السنتي مورغان” (Centimorgan) كمقياس لمدى الارتباط الجيني، ويعادل 1% من إعادة التركيب. على سبيل المثال، إذا رُصدت إعادة تركيب بمقدار 10% بين جينين، يكون الفاصل بينهما 10 سنتي مورغان تقريبًا على الخريطة الجينية.
تطبيقات خرائط الربط
تُعد خرائط الربط أداة حاسمة في أبحاث الوراثة الجزيئية وتربية النباتات والحيوانات. إذ تسمح للعلماء بتحديد مواقع الجينات المرتبطة بأمراض أو صفات مهمة مثل الإنتاجية ومقاومة الأمراض في النباتات أو الصفات الإنتاجية في الحيوانات الزراعية. باستخدام تقنية “الواسمات الجزيئية” (Molecular Markers) مثل تعدد أشكال النوكليوتيدات المفردة (SNPs) وتكرارات التسلسل البسيطة (SSRs)، يمكن بناء خرائط ربط عالية الدقة. هذه الخرائط تساعد على التعرف على الجينات أو المناطق الجينومية المسؤولة عن الصفات المرغوبة وتسريع عمليات الانتخاب في برامج التربية.
مستويات العبور: العبور الفردي والمزدوج والمتعدد
لا يحدث العبور دائمًا في نقطة واحدة فقط بين الكروموسومات المتماثلة خلال الانقسام المنصف؛ فقد يتكرر في أكثر من موضع على طول الكروموسوم نفسه. يمكن تمييز ثلاثة أنماط رئيسية:
- العبور الفردي: يحدث عند نقطة واحدة فقط على طول الذراعين المتماثلين للكروموسومات، مما يسمح باستبدال قطعة واحدة من المادة الوراثية.
- العبور المزدوج: يحدث في نقطتين على الأقل، ما يؤدي إلى تبادل مقطعين. كثيرًا ما تفاجئنا هذه الأحداث بنتائج غير متوقعة في النمط الظاهري، لأنها قد تسترجع الترتيب الوراثي الأصلي في بعض الحالات.
- العبور المتعدد: يظهر عندما تقع عدة عمليات عبور على الذراع نفسه أو على الذراعين معًا. يشيع هذا النمط في الكروموسومات الكبيرة أو في الأنواع التي تملك جينومات واسعة، وقد يؤثر بشكل كبير على توزيع الأليلات عبر الأجيال.
يؤدي العبور المزدوج والمتعدد دورًا إضافيًا في تعقيد الأنماط الوراثية في السكان، حيث يمكن أن يكسر التركيب الارتباطي بين عدة جينات في وقت واحد، ما يسهم في إثراء التباين الوراثي.
الانعكاسات التطورية لظاهرة العبور
التنوع الوراثي والانتقاء الطبيعي
يُعتبر التنوع الوراثي المحرك الأساسي لعملية الانتقاء الطبيعي، إذ يختار الانتقاء الصفات الأكثر ملاءمةً للبقاء والتكاثر. كلما زاد التنوع الوراثي في المجتمع الحيوي، ارتفعت فرصة امتلاك الأفراد طفرات أو تراكيب جينية مناسبة في حال تغيّر الظروف البيئية. ومن هنا تكمن أهمية العبور في خلق طفرات مستمرة من التراكيب الجينية، ما يزيد من احتمالات النجاة الجماعية في مواجهة التحديات مثل الأمراض والتغيّرات المناخية ونقص الموارد الغذائية.
إلى جانب ذلك، يُعتقد أن عمليات العبور قد ساعدت في ظهور أنواع جديدة عبر التاريخ التطوري. إذ يمكن لخطوط وراثية مختلفة أن تتقارب في حال التزاوج بين تجمعين وراثيين يملكان قدرًا معينًا من التوافق. عندها يسهم العبور في تعزيز الاندماج الجيني وظهور صفات جديدة، ما قد يفضي في بعض الأحيان إلى نشوء تجمعات مميزة جينيًا يمكن أن تتطور إلى أنواع مستقلة.
الاستقرار الجيني والمخاطر المحتملة
رغم فوائده التطورية، قد يتسبب العبور في وقوع أخطاء جينية إن لم يتم إصلاحه بدقة. إذ ينطوي على مخاطر انحرافات كروموسومية (Chromosomal Rearrangements) أو حذف أو تضاعف أجزاء من المادة الوراثية إذا ما أخفقت الآليات الخلوية في إصلاح تقاطعات هوليداي بشكل صحيح. ومع أن نسبة هذه الأخطاء قليلة، فإنها قد تؤدي إلى اضطرابات جينية أو أمراض تنكسية لدى بعض الكائنات. تُظهر هذه الحقيقة أن التوازن بين الفوائد التطورية للعبور والمخاطر المرتبطة به هو نتاج تنظيم خلوي معقّد يهدف إلى تحقيق أقصى قدر من الفائدة التطورية بأدنى قدر من الضرر.
التقنيات الحديثة لدراسة ظاهرة العبور
الواسمات الجزيئية وتحليل التسلسل
قادت ثورة التقنيات الجزيئية في العقود الأخيرة إلى تطوير أساليب دقيقة لدراسة العبور. يتطلب تحليل الظاهرة على المستوى الدقيق التعرف على المواقع الجينومية التي حدث فيها تبادل للمقاطع الوراثية، وهذا يمكن رصده من خلال تتبع الواسمات الجزيئية. يساعد تسلسل الدنا (DNA Sequencing) وتحليل الاختلافات الجينية بين الأفراد أو السلالات في تحديد النقاط التي فُصلت أو أُعيد ترتيبها بسبب العبور.
من التقنيات الشائعة استخدام خرائط تعدد أشكال النوكليوتيدات المفردة (SNP Mapping)، إذ تُستخدم آلاف أو ملايين المواقع الجينومية المعروفة والموزعة على الكروموسومات لتحديد أنماط الوراثة. عند تتبع الأفراد الناتجين عن تهجين بين سلالتين مختلفتين، يمكن معرفة أيّ الواسمات قد فصلت عن بعضها وأيّها ظلت مرتبطة. بهذه الطريقة، يمكن تحديد مواقع العبور الدقيقة وحساب معدل إعادة التركيب.
المجهر الإلكتروني وتقنيات التصوير الحديثة
إلى جانب التحليلات الجزيئية، ساعد التطور في تقنيات التصوير المجهري الإلكتروني وتلوين الكروموسومات في مشاهدة الظواهر الخلوية مباشرة. تُمكّن هذه التقنيات من رؤية المركب المشبكي (Synaptonemal Complex) في الطور التمهيدي الأول من الانقسام المنصف، وكذلك أماكن حدوث التقاطعات. يُتيح هذا الرصد المباشر تحليلًا أفضل لبنية تقاطع هوليداي ورؤية كيفية تحركه واستقراره في أثناء هجرة الفروع.
تطبيقات ظاهرة العبور في التربية وتحسين الصفات
برامج التربية النباتية والحيوانية
يُعد استثمار العبور جزءًا أساسيًا من استراتيجيات التكاثر الانتقائي للنباتات والحيوانات الزراعية. يعتمد مربو النباتات مثلًا على تهجين سلالات تمتلك صفات متميّزة كالإنتاجية العالية أو المقاومة للأمراض. في الأجيال اللاحقة، تتولد أنماط وراثية متنوعة بفعل العبور بين الجينات المسؤولة عن تلك الصفات. وبالانتقاء المنهجي للأفراد الحاملة للتراكيب المرغوبة، يمكن تطوير أصناف محسّنة تمتلك توليفة فريدة من الصفات الإيجابية.
يشمل الأمر ذاته الحيوانات الزراعية، كالماشية والدواجن. عند تهجين سلالات تحمل خصائص متفوقة من حيث إنتاج الحليب أو اللحوم أو البيض، تُستخدم ظاهرة العبور لضمان تبادل جينات معيّنة مرتبطة بالجودة ومقاومة الأمراض. ويمكن للتطور في مجال الواسِمات الجزيئية أن يعزّز هذا النهج، بحيث يُقاس معدل العبور بدقة ويحدَّد التسلسل الجيني المسؤول عن الصفات المستهدفة. هذا يتيح تحسين السلالات على نحو أسرع وأكثر دقة.
الهندسة الوراثية والتحرير الجيني
على الرغم من أن التقنيات الحديثة مثل التحرير الجيني بأدوات كـ CRISPR-Cas9 تسمح بتعديل الجينات مباشرة، لا تزال ظاهرة العبور مهمة في دمج الصفات الجديدة ضمن الجينوم واستقراره على المدى البعيد. على سبيل المثال، إذا نُقل جين معيّن إلى نبات بهدف تعزيز مقاومته للآفات، فإن دمجه مع جينات أخرى مفيدة أو فصله عن جينات غير مرغوبة يحدث عبر آليات طبيعية تعتمد على العبور. بهذا، يمكن ضمان حفظ الصفة الجديدة ضمن الجينوم بشكل متسق وآمن عبر الأجيال.
تأثير ظاهرة العبور في الأمراض الوراثية والطب الحديث
الاضطرابات الوراثية المرتبطة بأخطاء العبور
قد تؤدي بعض الأخطاء أثناء العبور إلى مشكلات صحية خطيرة. فعلى سبيل المثال، إذا حدث عبور غير متماثل بين كروموسومات مرتبطة، يمكن أن ينشأ حذف جيني (Deletion) في أحد الكروموسومين، وتضاعف جيني (Duplication) في الكروموسوم الآخر. يؤدي هذا الأمر إلى اختلال في الجرعة الجينية لتلك المناطق؛ فإذا احتوت تلك المناطق على جينات حاسمة للنمو أو الوظائف الحيوية، قد تظهر أمراض وراثية أو عيوب خلقية.
من الأمثلة المعروفة على ذلك متلازمة الحذف (Cri du Chat Syndrome) في البشر الناتجة عن حذف جزء من الذراع القصير للكروموسوم 5. رغم أن هذا الحذف قد لا يكون دائمًا بسبب العبور حصريًا، فإن حدث العبور الخاطئ يظل أحد السيناريوهات الممكنة لحدوث مثل هذه الطفرات الضارة. تُظهر هذه الحالات أن ظاهرة العبور ورغم فوائدها الكبيرة في التنوع الوراثي، إلا أنها قد تحمل جانبًا سلبيًا إذا ما انحرفت عن مسارها الطبيعي.
تشخيص الأمراض والاستشارات الوراثية
في مجال الاستشارات الوراثية، يعد فهم معدلات العبور والارتباط بين الجينات أمرًا أساسيًا لتقدير احتمالات انتقال بعض الطفرات المسببة للأمراض. إذا كانت هناك جينات مسببة لمرضٍ ما على كروموسوم معيّن، فإن معرفة احتمالية العبور بينها وبين واسمات جزيئية أخرى يسهّل تتبعها في الأسر التي ينتشر فيها المرض. يمكن استخدام هذا النهج لتقدير مخاطر إنجاب أطفال مصابين، أو لتحديد احتمالات انتقال المرض عبر الأجيال.
علاوةً على ذلك، تسمح التقنيات الجزيئية المعتمدة على تحليل التسلسل واستخدام الخرائط الجينية بتشخيص الأمراض الوراثية في مرحلة مبكرة. فعند إجراء فحص جيني للأجنّة أو حديثي الولادة، يمكن رصد مؤشرات لوجود تبادل جيني غير طبيعي. إذا جرى اكتشاف مشكلة ما بشكل مبكر، يمكن اتخاذ إجراءات وقائية أو علاجية محتملة، لا سيما في أمراض يمكن التخفيف من أعراضها عبر الرعاية الطبية المبكرة.
المقارنة بين ظاهرة العبور وإعادة التركيب في الكائنات بدائية النوى
تختلف آليات إعادة التركيب في الكائنات بدائية النوى (كالجراثيم) عن تلك التي تحدث في حقيقيات النوى. لا تمتلك بدائيات النوى الانقسام المنصف كما في الكائنات الأعلى، لكن تمتلك آليات خاصة مثل الاقتران البكتيري (Conjugation)، والتحول (Transformation)، والانتقال الفيروسي (Transduction). ورغم أن هذه العمليات ليست عبورًا بمعناه الصارم، فإنها تؤدي دورًا وظيفيًا مشابهًا من حيث تبادل المادة الوراثية وإغناء التنوع.
في المقابل، تؤدي ظاهرة العبور في حقيقيات النوى دورًا مزدوجًا: إذ لا تقتصر على المساهمة في إعادة تركيب الأليلات فحسب، بل تضمن أيضاً التوزيع السليم للكروموسومات المتماثلة أثناء الانقسام المنصف. كما تحافظ على استقرار البنية الصبغية من خلال إصلاح الكسور والتلفيات ضمن إطار تبادل المقاطع. ورغم تشابه المبادئ العامة لإعادة التركيب في كلا النوعين، تظل ظاهرة العبور في حقيقيات النوى أكثر تعقيدًا وترتبط مباشرة بتكوّن الأمشاج.
أهمية ظاهرة العبور في فهم البنية الجينومية والتنظيم الوراثي
لا يقتصر تأثير العبور على بناء خرائط الربط أو تنويع الأليلات بين الأجيال، بل يمتد أيضًا إلى التأثير في البنية الجينومية على المدى البعيد. يساعد العبور على تفكيك أنماط الارتباط القوية (Linkage Disequilibrium) في الجينوم، وهي حالة تُشير إلى وجود ميل لبقاء مجموعات معينة من الأليلات مرتبطة معًا عبر الأجيال. بتحرر هذه الأليلات من ارتباطها السابق، يتوسع نطاق التنوع الجيني المتاح لتطوّر الصفات والوظائف الجديدة.
كما يسهم العبور في تقليل ما يُعرف بـ”السحب الجيني” (Genetic Hitchhiking)، عندما تُجر أليلات محايدة أو حتى ضارّة عبر الأجيال لأنها مرتبطة بأليلات مفيدة. إذا حدث العبور بالقرب من الجين المفيد، فقد يتحرر الجين المرتبط من هذه الرابطة غير المرغوبة، مما يسمح للانتقاء الطبيعي بالتركيز بشكل أفضل على الأليلات المفيدة أو استبعاد الأليلات الضارة. بذلك، يكون للعبور دور فعال في إدارة تراكم الطفرات، وتعزيز الكفاءة الانتخابية للسكان.
المحددات التي تؤثر على مواقع العبور على طول الكروموسومات
بنية الدنا والكروماتين
أظهرت الأبحاث أن بنية الكروماتين (Chromatin) تؤثر في توزع العبور على طول الكروموسومات. فالمناطق شديدة التكثيف (Heterochromatin) تكون عادة أقل عرضة للعبور بسبب صعوبة وصول آليات الإصلاح والتبادل إلى الدنا المكثف. بينما تتميز المناطق ذات التفاف الكروماتين الأقل (Euchromatin) بارتفاع معدل العبور نتيجة تسهيل الوصول لبروتينات الإنزيمات المتدخلة.
كما ترتبط بعض التسلسلات الدناوية المحفزة للعبور بتكوين بروتينات محددة قد تزيد أو تقلل من احتمال حدوث تقاطع هوليداي. يُشار إلى أن للجينات التي تتمتع بتسلسلات متكررة أو عناصر تنظيمية محددة دورًا في جعل مناطقها أكثر أو أقل جاذبية لأحداث العبور، الأمر الذي يؤدي في النهاية إلى إعادة تشكيل الجينوم مع مرور الزمن.
تأثير الطول الكروموسومي وتعدّد نقاط التحكم
عادة ما تشهد الكروموسومات الأطول معدلات أعلى من العبور بسبب توافر مساحة أكبر لتشكل التقاطعات. ومع ذلك، لا يقتصر الأمر على الطول فقط؛ إذ توجد نقاط تحكّم جزيئية تشرف على توزيع العبور حتى لا تتركّز جميع أحداث العبور في منطقة محددة وتترك مناطق أخرى. تُعرف هذه الظاهرة بالتداخل (Interference) التي نوقشت سابقًا، وهي آلية تضمن توزيع التقاطعات بنمط يحدّ من تكدسها في نقاط متقاربة جدًا.
كما توجد بروتينات تشارك في مراقبة جودة العبور وعدد مرات حدوثه على طول الكروموسوم. تساعد هذه البروتينات على منع زيادة عدد التقاطعات فوق الحد الذي قد يعرّض استقرار الكروموسوم للخطر، وتضمن في الوقت نفسه أن هناك على الأقل نقطة عبور واحدة على كل زوج متماثل للمساعدة في الفصل الصحيح للكروموسومات.
العبور والجوانب التطبيقية في عالم الجينوميات الحديثة
تحليل الارتباط (Association Mapping) ودراسات الارتباط على نطاق الجينوم (GWAS)
في السنوات الأخيرة، ازدادت أهمية العبور في دراسات واسعة النطاق تُعرف باسم دراسات الارتباط على نطاق الجينوم (Genome-Wide Association Studies – GWAS). تسعى هذه الدراسات إلى الربط بين الاختلافات الجينية (مثل SNPs) وصفات أو أمراض معينة لدى مجموعات كبيرة من الأفراد. يلعب العبور دورًا مهما في تشكيل الأنماط الفردانية (Haplotypes) على طول الكروموسومات، وتحديد طول الامتدادات التي تبقى مرتبطة معًا عبر الأجيال. إذا كان معدل العبور مرتفعًا في منطقة ما، تصبح تلك المنطقة أكثر تجزؤًا جينيًا ويصعب فيها اكتشاف الارتباطات الكبيرة، في حين يُسهّل معدل العبور المنخفض رصد مناطق جينومية واسعة مرتبطة بالصفة المدروسة.
يفيد فهم ديناميات العبور في تحسين تفسير نتائج GWAS، والتفريق بين الجينات السببية (Causal Genes) وجينات أخرى مرتبطة ببساطة لأنها تقترب مكانيًا على الكروموسوم. كما يمكن أن يساعد في فهم الدور المعقد للوراثة متعددة الجينات (Polygenic Inheritance) في ظهور الأمراض أو الصفات ذات الأساس الجيني المعقّد.
تصميم تجارب التهجين والمسوحات الجينية
عند تصميم تجارب التهجين لدراسة وراثة الصفات المعقّدة، يُؤخذ معدل العبور بعين الاعتبار. على سبيل المثال، يختار الباحثون سلالات أو أصنافًا وراثية متباعدة نسبيًا لزيادة احتمالية حدوث العبور بين الجينات، ما يؤدي لظهور اختلافات ملموسة في الأجيال الناتجة. كذلك، تؤثر المعرفة التفصيلية بالعبور في طريقة أخذ العينات وحجمها، ومدة الدراسة الزمنية المطلوبة لتحليل أنماط إعادة التركيب.
من جهة أخرى، يساعد العبور في تحليل نسب الصفات الوراثية وتحديد ما إذا كان سلوكها يخضع لارتباط جيني قوي أم لا. فإذا لوحظ تغير كبير في توزيعات الصفات مقارنة بالنسب المندلية الكلاسيكية، فهذا يشير إلى إمكانية وجود عبور متكرر أو ارتباط وثيق بين عدة جينات مسؤولة عن التعبير الظاهري.
الاعتبارات الأخلاقية والاجتماعية لاستخدام ظاهرة العبور
رغم أن ظاهرة العبور هي ظاهرة طبيعية، إلا أن الاستفادة منها في مجالات التربية الحيوانية والنباتية تثير بعض التساؤلات الأخلاقية. فالتدخل البشري المكثف في تهجين الأصناف والكائنات يمكن أن يؤثر على التنوع الحيوي إذا لم يُدار بشكل واعٍ. قد يؤدي اختيار صفات محددة باستمرار إلى التضييق التدريجي في البنية الوراثية للسلالات، مما يجعلها أقل قدرة على التأقلم مع الظروف البيئية الطارئة.
كما ترتبط دراسة العبور بتطوير أدوات الهندسة الوراثية والتحرير الجيني، وهذه المجالات تشهد جدلًا أخلاقيًا حول حدود التعديل الجيني المسموح به. من المهم وضع تشريعات ومعايير أخلاقية تضمن احترام التوازن بين الاستفادة العلمية والاقتصادية من ظاهرة العبور، وحماية الطبيعة وصحة الإنسان. في هذا الإطار، تبرز أهمية النقاشات المجتمعية والمؤسسية وتبنّي سياسات شفافة تضمن الاستخدام المسؤول لهذه الأدوات.
ظاهرة العبور في المجال التطبيقي: أمثلة توضيحية
يمكن ضرب أمثلة عملية لفهم مدى توظيف ظاهرة العبور في التطبيقات المختلفة:
- العبور في زراعة القمح: يسعى الباحثون لتحسين صفات مثل مقاومة الصدأ أو الجفاف في أصناف القمح عن طريق تهجين أصناف تحمل جينات المقاومة مع أصناف عالية الإنتاجية، ثم يتم الانتخاب للأفراد التي تجمع الصفتين معًا بفضل العبور.
- تطوير سلالات أبقار محسّنة: تستخدم ظاهرة العبور في تصالب سلالات معروفة بإنتاجية عالية للحليب مع سلالات تتمتع بمقاومة للأمراض، فينتج عنها أفراد تجمع الجينات المفيدة في آن واحد.
- دراسة أمراض الإنسان: في البحوث الطبية، تُعد خرائط الربط والعبور أداة للكشف عن الجينات المسؤولة عن أمراض وراثية؛ حيث يُستدل بمعدلات العبور في تحديد الترتيب النسبي لمجموعة من الجينات، وبالتالي التنبؤ بالمواقع التي يرجح أن تكون مصدر الخلل الجيني.
جدول يلخص أنماط العبور واختلافاتها
| النمط | عدد التقاطعات | مدى توليد التنوع | أمثلة في الكائنات الحية |
|---|---|---|---|
| العبور الفردي | 1 | توليد تنوع متوسط | معظم الكائنات الحقيقية النوى |
| العبور المزدوج | 2 | تنوع أعلى وقد يُعيد التركيب الأصلي | الذباب، النباتات ذات الجينومات المتوسطة |
| العبور المتعدد | 3 فأكثر | تنوع كبير واحتمال تباين جيني مرتفع | الحبوب مثل الذرة والقمح والأنواع ذات الكروموسومات الكبيرة |
الآفاق المستقبلية لدراسة ظاهرة العبور
التطوير التقني والجيني
مع تطور تقنيات التحليل الجينومي الشامل، يُتوقع أن يزداد الفهم الدقيق للعبور وآليات تنظيمه. ربما سنشهد في المستقبل القريب إمكانية التلاعب بمعدلات العبور في مواقع محددة من الجينوم باستخدام تقنيات التحرير الجيني المتقدمة. هذا قد يساعد المربين والباحثين على زيادة فرص إعادة الخلط الوراثي في مناطق كروموسومية ترتبط بصفات حيوية أو على تقليلها في مناطق أخرى قد تسبب اضطرابات أو مشاكل.
كما يُتوقع أن تشهد العقود القادمة نقلة نوعية في مجال علم الجينوم المقارن (Comparative Genomics)، إذ ستتيح وفرة البيانات الناتجة عن تسلسل جينومات العديد من الكائنات دراسة أنماط العبور عبر أنواع مختلفة ومقارنتها للوقوف على التشابهات والاختلافات. بذلك، سيكون بالإمكان تحديد ما إذا كانت هناك آليات تطورية عامة أو محددة لكل نوع، وما إذا كانت هناك “مناطق ساخنة” (Hotspots) للعبور متشابهة بين الكائنات المختلفة.
تطبيقات الطب الشخصي
في مجال الطب الشخصي (Personalized Medicine)، يُعد تحليل طفرات الأفراد وأنماط إعادة التركيب الجيني بينهم حجر الأساس لتصميم علاجات مخصصة. قد يساعد التنبؤ بالأنماط العبرية التي قد تحدث في أجيال لاحقة على فهم توريث الطفرات المسببة للأمراض بشكل أفضل، وتطوير استراتيجيات وقائية أو علاجية تتناسب مع التركيب الجيني لكل مريض على حدة. ومع نضوج تطبيقات التحرير الجيني، يمكن الوصول إلى إمكانيات تعويض أو منع أخطاء العبور على نحو دقيق.
المزيد من المعلومات

















